Contacte-nos - 210996971 - info@ibdciencia.pt
Estudiando el comportamiento de los gases: ecuación de estado y ley de dilatación de los gases
OBJETIVO DE LA PRÁCTICA
Práctica dirigida a los alumnos de química de 2º Eso . Estudiaremos el comportamiento de los gases, en este caso aire, cuando se calientan, a volumen constante o a presión constante. Por tanto, comprobaremos la ecuación de estado o general de los gases.
MATERIALES NECESARIOS
- Aro
- Base soporte
- Jeringa de 50 ml
- Mechero
- Nuez doble (5)
- Pinza Hoffman
- Tapón de goma trihoradado
- Termómetro
- Tubo acodado 70 x 70
- Tubo de ensayo
- Tubo de silicona de 7 x 5 cm
- Tubo de silicona de 5 x 3 cm
- Tubo de vidrio 6 x 65 mm
- Tubo en U con escala
- Varilla soporte 12 x 250 mm
- Varilla soporte roscada
- Vaso de precipitado
FUNDAMENTO TEÓRICO
Vamos a comprobar experimentalmente cómo se cumple la ecuación de estado para los gases ideales:
![]()
teniendo en cuenta que se estará cometiendo un error debido a la no idealidad del gas. Existen otras ecuaciones con constantes correctoras de esta no idealidad.
El valor que toma R para 1 mol, es decir n = 1, será la llamada constante universal de los gases y tiene un valor de 0,082 atm1/Kmol.
La compresibilidad de los gases complica algo más el estudio de la dilatación de estos, de tal manera que se cumple:
![]()
Siendo a el coeficiente de dilatación a p constante.
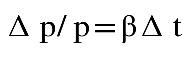
Siendo b el coeficiente de dilatación a volumen constante.
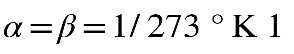
INSTRUCCIONES PARA REALIZAR LA PRÁCTICA
Realizar la práctica como indica la figura, de tal manera que en la salida de la jeringa se coloque 1 cm de tubo de silicona de 5 x 3 cm y posteriormente 8 cm de tubo de silicona de 7 x 5 cm, de forma que quede hermética la unión jeringa con el tubo de ensayo.
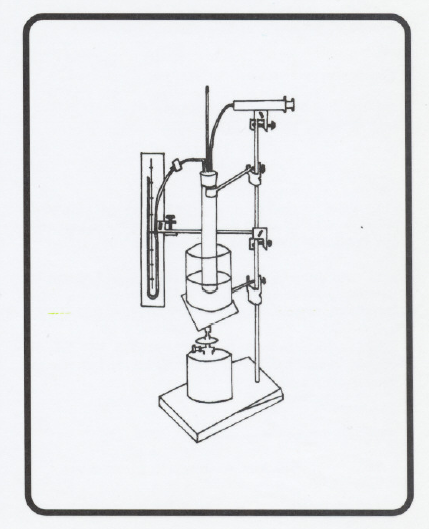
Extender glicerina en el émbolo de la jeringa para disminuir el rozamiento y asegurar la hermeticidad.
No se debe olvidar la pinza de Hoffman, antes de unir el manómetro al tubo de ensayo.
1/ Dilatación
En un principio cerrar el contacto al manómetro con la pinza de Hoffman y calentar el agua del vaso hasta ebullición.
Observamos que al ir aumentando la temperatura comenzará a moverse el émbolo de la jeringa, tanto más, cuanto más se eleve la temperatura.
Al llegar el agua a ebullición, abrimos la pinza Hoffman y las columnas del manómetro se desigualarán. Posteriormente moviendo el émbolo de la jeringa se debe igualar.
En ese momento leemos el volumen en la jeringa d1 y la temperatura t1.
Extraemos el agua del vaso y ponemos agua fría, de tal manera que el volumen disminuirá. De la misma manera se alterarán las ramas del manómetro, para conseguir que el dato sea a presión constante.
Movemos el émbolo de la jeringa hasta conseguir que las ramas se igualen y leemos t2 y d2.
Así la variación de volumen será:
![]()
Variación de temperatura
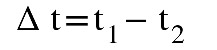
Calculamos el volumen de aire en el tubo de ensayo, y posteriormente calculamos el volumen de agua que entra, y se tendrán todos los datos, sustituyendo en 2 cálculo a.
2/ Comprobación de la ecuación de estado
Partiendo de la temperatura de la anterior experiencia, igualamos las ramas del manómetro y tomamos los siguientes datos:
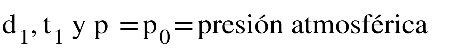
Comienza a calentar y tomar datos de altura del manómetro, temperatura y volumen en el émbolo de la jeringa a cada intervalo de 4º C. Teniendo en cuenta:
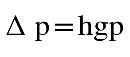
Volumen de gas será igual al volumen del tubo de ensayo más el volumen de la jeringa.
Rellenamos la siguiente tabla:
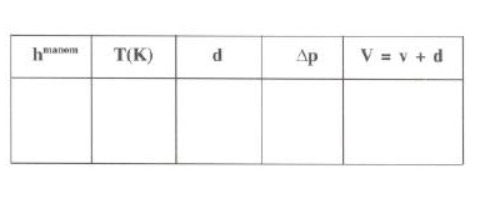
Con estos datos se podrá comprobar:
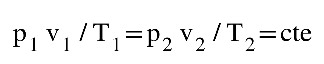
CUESTIONARIO
Leemos la presión atmosférica local en el manómetro del laboratorio.
Calculamos el valor de a partir de los datos. Comparamos con el valor teórico. ¿Los valores coinciden? ¿A qué puede ser debido la diferencia?
Se cumple con exactitud la ecuación de estado de los gases. ¿Por qué?
¿Qué conclusiones obtienes después de haber realizado esta práctica?
VIDEO DE LA PRÁCTICA
Leave a Comment
Leave a Reply
Por favor, fIniciar sessão para publicar um comentário.


